赵国平课题组在线粒体靶调控辐射敏感性研究中取得重要进展
近日,中科院合肥研究院强磁场中心赵国平课题组在肿瘤放疗敏感性研究中取得重要进展,相关研究成果发表在国际期刊Oncogene上。该研究首次发现线粒体功能蛋白HIGD1A在辐射刺激下转位入核,参与调控核内DNA同源重组修复(HR)并介导肿瘤放疗敏感性,这将对解析线粒体靶在辐射敏感性中的作用具有重要意义。
DNA损伤反应是肿瘤放射治疗的基本原理,辐射通过破坏DNA杀伤肿瘤细胞,而肿瘤组织的放射抗性则与异常增强的DNA损伤修复能力相关。因此抑制肿瘤细胞的DNA损伤修复能力,会成为增强肿瘤放射治疗效果的有效途径,将为研制新型癌症治疗剂奠定基础。线粒体是真核细胞中重要的细胞器,是物质代谢和能量转换的中心。传统观点认为外源信号诱导的DNA损伤修复信号是由线粒体ROS介导的。后来不断有研究发现,DNA损伤修复途径高度依赖能量,细胞能量耗竭会导致DNA修复不完全,最终会导致细胞死亡。并且,在TCA循环中形成的代谢产物是DDR通路中关联蛋白的重要底物。这些研究均表明线粒体广泛参与了核内DNA损伤修复途径。近期研究还发现,线粒体蛋白HIGD1A在严重应激下具有明显的核定位,暗示其可能具有额外的“月光作用”,在核内损伤中发挥重要的调控作用,但是具体机制并不明确。
在本研究工作中,科研人员通过运用生物信息学分析、RNA-seq、LC-MS/MS等技术手段,发现辐射诱导HIGD1A的转位入核依赖于核孔复合物,核孔蛋白NUP93通过与HIGD1A保守序列内的46-60氨基酸直接作用介导HIGD1A入核。进一步研究发现,HIGD1A入核后与RPA作用调控HR。在HR的早期阶段,HIGD1A促进RPA加载到DSB损伤位点处并增强9-1-1以DNA损伤依赖的方式在染色质上结合,从而激活ATR-Chk1依赖的G2/M周期损伤检查点。在HR的后期阶段,在促进RPA-ssDNA结合后,HIGD1A反过来通过促进RPA1的泛素化并诱导其最终的蛋白酶体降解来抑制RPA1病灶的异常持续存在,使HR得以最终完成。此外,使用虚拟筛选方法确定了与HIGD1A-NUP93相互作用结合口袋相关的临床药物Preveon。经液体NMR验证,该化合物可直接与HIGD1A相互作用,能够抑制辐射诱导的HIGD1A转位入核。总的来说,该研究证明了HIGD1A在辐射诱导的DNA损伤中的新功能,并为使用HIGD1A抑制剂作为癌症治疗剂提供了基本原理。
本研究工作得到了国家自然科学基金、中科院相关项目、合肥研究院院长基金等项目的资助和支持。核磁共振工作在稳态强磁场实验装置(SHMFF)的核磁共振谱仪系统上完成。
文章链接:https://www.nature.com/articles/s41388-022-02226-9
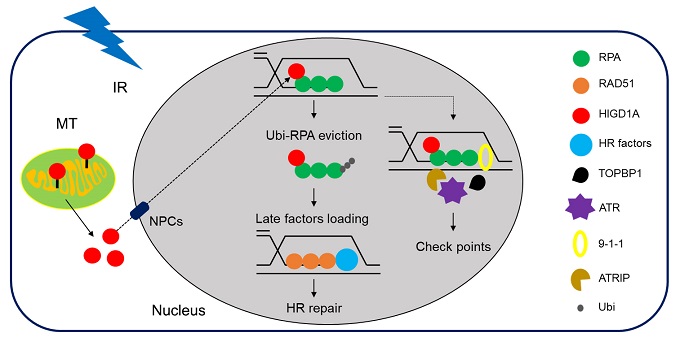
HIGD1A调控DNA损伤修复示意图


